【药品名称】
通用名称:丁苯酞氯化钠注射液
英文名称:Butylphthalide and Sodium Chloride Injection
汉语拼音:Dingbentai lühuana Zhusheye
【成 份】本品活性成份为丁苯酞,其化学名称: dl-3-丁基-1(3H)-异苯并呋喃酮。
【性状】本品为无色的澄明液体。
【适应症】 用于急性缺血性脑卒中患者神经功能缺损的改善。
【规 格】100ml:丁苯酞25mg与氯化钠0.9g。
【用法用量】 本品应在患者发病后48小时内开始给药。
静脉滴注,每日2次,每次25mg(100ml),每次滴注时间不少于50分钟,两次用药时间间隔不少于6小时,疗程14天。
PVC输液器对丁苯酞有明显的吸附作用,故输注本品时仅允许使用PE输液器。
本品在发病48小时后开始给药的疗效、安全性尚无研究数据。
产品详情
说明书下载

【药品名称】
通用名称:丁苯酞氯化钠注射液
英文名称:Butylphthalide and Sodium Chloride Injection
汉语拼音:Dingbentai lühuana Zhusheye
【成 份】本品活性成份为丁苯酞,其化学名称: dl-3-丁基-1(3H)-异苯并呋喃酮。
化学结构式:
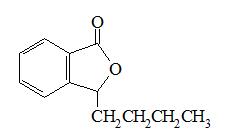
分子式:C12H14O2
分子量:190.24
辅 料:氯化钠、羟丙基-β-环糊精、注射用水。
【性状】本品为无色的澄明液体。
【适应症】
用于急性缺血性脑卒中患者神经功能缺损的改善。
【规 格】100ml:丁苯酞25mg与氯化钠0.9g。
【用法用量】
本品应在患者发病后48小时内开始给药。
静脉滴注,每日2次,每次25mg(100ml),每次滴注时间不少于50分钟,两次用药时间间隔不少于6小时,疗程14天。
PVC输液器对丁苯酞有明显的吸附作用,故输注本品时仅允许使用PE输液器。
本品在发病48小时后开始给药的疗效、安全性尚无研究数据。
【不良反应】
丁苯酞氯化钠注射液组(n=606)和对照组(n=243)不良事件总体发生率分别为24.59%和26.75%,研究者判断不良事件与试验药物的关系多为无关或可能无关,其中,多形红斑形药疹(药疹)可能与试验药物有关,未发生与试验药物有关的严重不良事件。
Ⅰ期临床研究(n=84):不良反应仅在单次给予丁苯酞较大剂量时出现,80mg组1例受试者出现轻度双眼不适(1/6),100mg组1例受试者出现困倦思睡(1/4)、2例受试者出现肢体酸软(2/4)、1例受试者出现头部昏沉感(1/4),120mg及160mg组共有6例受试者出现心率减慢(6/10),最慢心率42次/分钟,多于停药后逐渐恢复正常。多次给药组10例受试者,用药方法为每次50mg每日二次连续给药,其中2例受试者出现AST升高、1例受试者出现ALT升高、1例受试者出现肢体酸软。
Ⅱ、Ⅲ期临床研究:丁苯酞组(n=522)和对照组(n=229)不良反应发生率分别为7.47%和6.99%,按系统分类,两组间不良反应发生率及实验室检查均无统计学差异(P>0.05)。不良反应发生率采用下列方法表示:非常常见(≥1/10);常见(≥1/100,<1/10);不常见(≥1/1000,<1/100);罕见(≥1/10000,<1/1000);非常罕见<1/10000)。
神经系统:不常见,包括头晕(0.19%,对照组0.00%)、头痛(0.57%,对照组0.44%)、昏迷脑疝(0.38%,对照组0.00%)。
呼吸系统:不常见,包括胸闷(0.57%,对照组0.00%)、呼吸困难(呼吸0.19%,对照组0.00%)。
胃肠系统:不常见,腹泻(0.57%,对照组0.00%)
皮肤及附件:不常见,包括皮肤瘙痒(0.19%,对照组0.44%)、过敏性皮炎(0.19%,对照组0.44%)、输液部位局部皮肤发红(0.19%,对照组0.00%)、皮疹(0.57%,对照组0.87%)。
全身异常:不常见,肢体无力加重(0.19%,对照组0.00%)、症状加重(0.19%,对照组0.00%)。
实验室检查结果异常:
谷丙转氨酶升高(≥2倍),丁苯酞氯化钠注射液组2.49%(停药后恢复),对照组1.32%。
肌酐升高:丁苯酞氯化钠注射液组0.38%,对照组0.00%。
尿素氮升高:丁苯酞氯化钠注射液组0.19%,对照组0.44%。
血液血小板和出血、凝血障碍:血小板计数升高,丁苯酞氯化钠注射液组0.19%,对照组0.44%。血小板计数降低,丁苯酞氯化钠注射液组0.19%,对照组0.44%。
【禁忌】
1、对本品任何成份过敏者。
【注意事项】
1、心动过缓、病窦综合征患者慎用。
2、肝功能受损者慎用。
3、有严重出血倾向者慎用。
4、羟丙基-β-环糊精通过肾小球滤过清除,因此,肌酐清除率<30ml/min的患者慎用本品。
【孕妇及哺乳期妇女用药】本品用于妊娠期和哺乳期妇女的安全性尚未建立。
【儿童用药】本品用于儿童的疗效、安全性尚未建立。
【药物相互作用】尚不明确。
【药物过量】
尚无药物过量的报道。
单次给药耐受试验提示本品在剂量过大时可导致心动过缓,应予以关注(参见不良反应)。
【临床试验】
Ⅱ期临床研究采用多中心、随机、双盲、多剂量平行对照的研究方法。共入组首次发病48小时内的颈内动脉系统脑梗死受试者199例,结果显示2次/日,25mg/次剂量组疗效与其它剂量组相比具有优势。
Ⅲ期临床研究采用多中心、随机、双盲双模拟、阳性药对照研究。共入组首次发病48小时以内的颈内动脉系统脑梗死受试者(NIHSS 6-25分)552例,其中丁苯酞氯化钠注射液组370例,奥扎格雷钠注射液组182例。
全分析集(FAS集)(n=552)统计分析结果:
丁苯酞氯化钠注射液组在治疗第8天、第15天NIHSS总评分(6.68±3.99、5.07±4.12)、BI总评分(54.70±25.50、63.78±27.06)与治疗前NIHSS(8.72±3.13)、BI(45.27±20.81)相比,差异均有统计学意义(P<0.001)。
与治疗前比较,丁苯酞氯化钠注射液组治疗后第15天NIHSS总评分的下降值为3.65±3.29,奥扎格雷钠注射液对照组为3.25±2.66,组间比较差异有统计学意义(P=0.034)。丁苯酞氯化钠注射液组治疗前后NIHSS变化率(总评分差值/治疗前总评分)为44.05±40.90%,奥扎格雷钠注射液组为41.24±34.22%,组间比较差异无统计学意义(P=0.088)。以治疗前的NIHSS总评分为协变量,治疗前后两组NIHSS总评分变化值的协方差分析结果显示,治疗后第15天差异有统计学意义(P=0.035)。
与治疗前比较,丁苯酞氯化钠注射液试验组治疗后第15天BI总评分的增加值为18.51±20.44,奥扎格雷钠注射液对照组为16.15±18.10,组间比较差异无统计学意义(P=0.065);丁苯酞氯化钠注射液试验组治疗前后BI变化率(总评分差值/治疗前总评分)为53.12±70.21%,奥扎格雷钠注射液对照组为43.85±58.37%,组间比较差异有统计学意义(P=0.041);以治疗前的BI总评分为协变量,治疗前后两组BI总评分变化值的协方差分析结果显示,治疗后第15天差异无统计学意义。
符合方案集(PPS集)统计分析结果:
丁苯酞氯化钠注射液组324例,奥扎格雷钠注射液组165例。在治疗后15天,丁苯酞氯化钠注射液试验组治疗前后NIHSS变化率为49.14±39.90%,奥扎格雷钠注射液对照组为44.88±33.54%,组间比较差异有统计学意义(P=0.024)。其他各项指标的统计结论与FAS集结论一致。在治疗后15天,丁苯酞氯化钠注射液试验组治疗前后BI差值(治疗第15天总评分-治疗前总评分)为20.42±20.84,奥扎格雷钠注射液对照组为17.52±18.33,组间比较差异有统计学意义(P=0.024)。其他各项指标的统计结论与FAS集结论一致。
本品Ⅲ期临床试验结果提示,以“治疗后第15天NIHSS总评分与基线值比较的下降值”作为主要疗效指标进行评价,在急性脑梗死发病后48小时内给药,丁苯酞氯化钠注射液可促进缺血性神经功能缺损的恢复,疗效不劣于奥扎格雷钠注射液。
【药理毒理】
药理作用
丁苯酞为人工合成的消旋正丁基苯酞,与天然的左旋芹菜甲素的结构相同。临床研究结果显示,丁苯酞对急性缺血性脑卒中患者中枢神经功能的损伤有改善作用,可促进患者神经功能缺损的改善。动物药效学研究显示,丁苯酞可阻断缺血性脑卒中所致脑损伤的多个病理环节,具有较强的抗脑缺血作用,可明显缩小大鼠局部脑缺血的梗塞面积,减轻脑水肿,改善脑能量代谢和缺血脑区的微循环和血流量,抑制神经细胞凋亡,并具有抗脑血栓形成和抗血小板聚集的作用。丁苯酞可能通过降低花生四烯酸含量,提高脑血管内皮NO和PGI2的水平,抑制谷氨酸释放,降低细胞内钙浓度,抑制自由基和提高抗氧化酶活性等机制发挥上述药效作用。
毒理研究
重复给药毒性:大鼠腹腔注射给予丁苯酞20、40、80 mg/kg,连续2个月。病理检查可见各组肺泡上皮细胞明显损伤,表现为肺泡上皮增生、肿胀、脱落等。高剂量组动物肝脏可见被膜增厚,纤维素膜增生包绕,慢性炎症细胞增生。各给药组及赋型剂组可见肾小管出现明显损伤,表现为肾小管肿胀、体积增大、胞浆淡染等,停药后逐渐恢复。Beagle犬静脉注射给予丁苯酞2、6、18mg/kg,连续2个月。病理检查可见高、中剂量组动物肺部出现局灶性片状肺泡上皮增生、肿胀、脱落,支气管炎性改变。高中剂量组动物可见肾小管上皮细胞出现轻度浊肿,胞体肿胀、胞浆淡染、核固缩,间质轻度扩张充血,停药后恢复。
遗传毒性:丁苯酞Ames试验、中国仓鼠肺细胞(CHL)染色体畸变试验及小鼠微核试验结果均为阴性。
生殖毒性:大鼠生育力与早期胚胎发育试验中,雌、雄动物经口给药(雌性动物为交配前给药二周,受孕后继续给药15天,雄性动物连续给药8周)80、200和500 mg/kg,结果对亲代动物生育力未见明显影响,未表现出明显的胚胎毒性和致畸作用,仅高剂量组动物摄水量明显增加,给药后前几天出现流涎、爬伏症状。围产期生殖毒性试验中,经口给予80、200和500 mg/kg ,高剂量组动物出现妊娠期延长趋势,其中一只孕鼠难产(剖检为死胎),少数动物无乳汁分泌,并出现幼仔(4日龄)存活率下降,幼仔(4日至3周龄)体重明显下降;高剂量组F1代大鼠斜板试验和悬垂试验分数降低(反映协调平衡能力),F2代幼仔骨骼发育有一定延迟;中、低剂量组未见明显影响。
【药代动力学】
单次给药药代动力学研究:中国健康受试者静脉输注含丁苯酞20mg、40mg和80mg的丁苯酞氯化钠注射液100ml,Tmax的中位数分别为0.84、0.84和1.00小时;T1/2的平均值分别为6.10±3.13、8.84±2.98、和9.63±2.59小时;Cmax的平均值分别为199.5 ±76.7、378.7±134.1和847.4±356.6ng/ml; AUC0-t的平均值分别为246.5±65.5、591.2±126.0和1261.8±259.0ng·hr/ml。统计分析结果显示,Cmax、AUC0-t和AUC0-∞随剂量增加而成比例增加。
多次给药药代动力学研究:中国健康受试者连续静脉输注丁苯酞氯化钠注射液,在第1天和第8天静脉输注50mg/次,1次/日,第3-7天静脉输注50mg/次,2次/日。在第1天和第8天单次给药后取血,丁苯酞的血浆平均达峰时间中位数均为1.00小时;平均消除半衰期分别为9.16±3.76和16.70±7.20小时;平均峰浓度分别为1319.5±703.0和635.8±226.2ng/ml;平均AUC0-t分别为907.4±192.2和1363.5±326.6 ng·hr/ml;平均AUC0-∞分别为942.5±186.6和1700.3±689.9ng·hr/ml。肾累积排泄量为18.81±8.95ug,肾清除率为21.2±10.4ml/hr,肾排泄剂量百分比为0.04±0.02%,说明尿中原形药物排泄比例小,大多数药物在体内被转化成代谢产物。稳态时的平均药物浓度(Cavg)为78.50±12.50 ng/ml,波动度(%F)为779.98±286.30%。在给予含丁苯酞50mg的氯化钠注射液100ml、每12小时1次的情况下,第五次连续给药起丁苯酞谷浓度不再增加,已达到稳态,观察蓄积比(Ro)为1.19±0.32,稳态蓄积比Rs为1.02±0.18,基本没有蓄积现象。
【贮藏】密闭保存。
【包装】玻璃瓶,100ml/每瓶。
【有效期】24个月。
【执行标准】国家食品药品监督管理局标准YBH01342010
【批准文号】国药准字H20100041
【生产企业】
企业名称:石药集团恩必普药业有限公司
生产地址:石家庄经济技术开发区扬子路88号
邮政编码:052160
电 话:0311-83092888
传 真:0311-83092777
网 址:www.nbp.com.cn
免费咨询电话:800-803-8825
 茂名市高新技术产业开发区恒基路99号
茂名市高新技术产业开发区恒基路99号
 0668-2093693
0668-2093693
 hfyy@hc24062076.com
hfyy@hc24062076.com